海沧生物医药捷报频传!
全省首个!“海沧造”抗原检测试剂盒,500万人份驰援泉州、莆田!
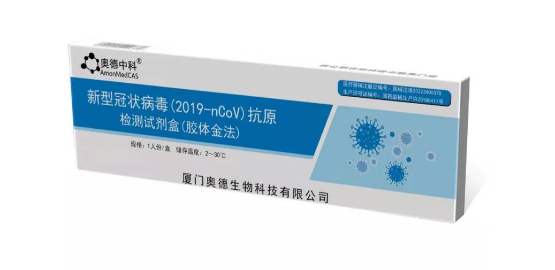
日前,奥德生物新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)获国家药监局注册批准上市,成为全省首家!
如今
还有一款产品正式获批上市
而且还是国内首个!!!
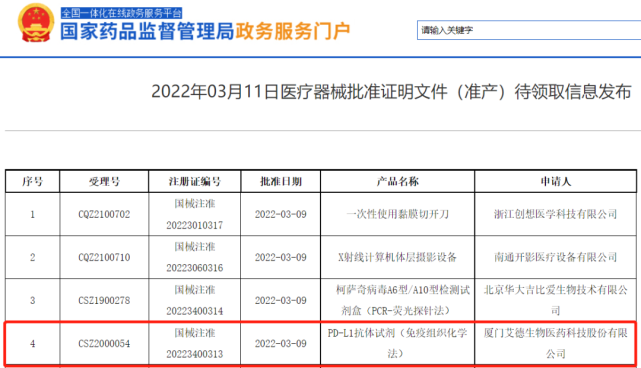
国家药品监督管理局日前发布了通知,艾德生物的“PD-L1抗体试剂(免疫组织化学法)”正式获批上市,成为中国批准上市的首个国产PD-L1检测试剂盒。
打破国外垄断,肿瘤患者的福音
PD-L1检测试剂盒对谁有利?为什么?
艾德生物注册部总监郑志杰介绍,这是肿瘤患者的福音。

一般来说,当体内细胞出现癌变时,会激活免疫系统,清除这些癌细胞。然而,癌细胞非常狡猾,会通过表达一种叫PD-L1的配体来 “掩护”自己,专门与免疫T细胞的PD-1相结合,抑制免疫系统,并诱导T细胞的凋亡,从而实现“免疫逃逸”。
所以,针对有“免疫逃逸”现象的肿瘤患者,可以选择免疫疗法,重启人体自身正常的抗肿瘤免疫反应,从而更加精准有效地对付癌细胞达到治疗癌症的目的。因此,不是每一个非小细胞肺癌患者都适合免疫治疗。
怎么办?PD-L1抗体试剂此时就派上用场了。
医生从非小细胞肺癌患者身上取3~5微米的肿瘤组织样本,放到切片上,通过PD-L1抗体试剂检测肿瘤细胞中PD-L1的表达情况,表达程度越高,说明患者越可能从免疫治疗中获益。
这样,医生通过检测,就可以更为精确地为患者选择合适的治疗方式。不适合免疫治疗的,医生会建议选择化疗、靶向治疗或者手术治疗等。

此前,我国批准上市的PD-L1检测试剂均为进口试剂,费用较高。艾德生物生产的PD-L1检测试剂获批上市后,让我国患者终于可以用上国产试剂,将帮助更多的肿瘤患者从免疫治疗中获益。
随着艾德生物PD-L1检测试剂的获批上市,我国肿瘤免疫治疗必将迈入新里程,从诊断到药物均有国产产品上市。
此消息对公司而言是利好,随着国产化的检测产品和医保药物的全覆盖,必将让更多肿瘤患者从精准免疫治疗中获益。——艾德生物相关负责人
扎根百亿蓝海,未来可期
PD-L1抗体试剂是免疫治疗药物的伴随诊断。
所谓伴随诊断(companion diagnostic,CD)是一种体外诊断技术,能够提供有关患者针对特定治疗药物的治疗反应的信息,有助于确定能够从某一治疗产品中获益的患者群体,从而改善治疗预后并降低保健开支。
据华夏时报报道,随着癌症患者人数逐渐增加,癌症诊疗新靶点的出现,检测渗透率不断提升,多基因检测技术等因素,国内伴随诊断市场规模或有望在2025年达到100亿元。目前,越来越多的企业开始布局伴随诊断管线。

作为国内伴随诊断行业的龙头,艾德生物持续关注抗肿瘤药物的研发和临床试验进展,与新药进行伴随诊断合作,以满足未来肿瘤临床检测需求,能够更好的服务患者。
据艾德生物2021年业绩快报显示,报告期内,营业总收入为91703.05万元,比上年同期上涨25.90%,营业利润为25736.62万元,增幅27.32%,利润总额25610.73万元,同比增长27.60%。
艾德生物表示,此次获批,势必带动公司获得更多的发展机遇。
据悉,为保障企业生产有序,艾德生物积极响应厦门疫情防控号召,按照相关要求,在3月21日之前,在厦300多名员工全部完成了核酸检测。3月21日凭借核酸检测报告进入园区,有序进行产品生产,持续保障肿瘤患者检测需求。

目前,艾德生物已经成功研发并获批上市24个肿瘤伴随诊断产品,部分产品在日本、韩国获批上市并进入当地医保,开创我国肿瘤伴随诊断产品海外获批的先例,成为国际公认的肿瘤精准医疗伴随诊断龙头企业。
(今日海沧)
(原标题:厦门捷报:国内首个!获批上市!打破国外垄断!)
null
网友评论
共有条评论, 人参与